Libro de Química 1 grado preparatoria primer semestre (contestado)
¿Buscas las respuestas a todas las preguntas del libro de Química 1 grado preparatoria? Aquí podrás consultar las respuestas de otros libros o descargar los documentos en PDF para tenerlos siempre a mano.
Puedes seguir haciendo scroll y encontrar las soluciones o pulsar ctrl + f (cmd + f en mac) en tu ordenador para buscar la respuesta a una pregunta que te han puesto como tarea. Te recomendamos que antes de mirar la respuesta intentes buscarla por ti mismo/a y que utilices esta página para comprobar si es correcta.
Libro de Química 1 grado preparatoria CONTESTADO
Puedes consultar las respuestas online o descargar el PDF aquí.
⇨ Navega por el índice de contenidos para conocer la respuesta que estás buscando: Aquí

La Química. Desarrollo histórico de la Química: los grandes momentos y su influencia en el desarrollo de la humanidad
Pág. 24
Realiza una línea del tiempo de la historia de la Química.

El método científico y sus aplicaciones
Pág. 35
Responde las siguientes preguntas
Cómo surgió el ácido salicílico y cómo se mejoróDe que el ácido salicílico tenía un sabor desagradable y ocasionaba daños gastrointestinales como reacciones secundariasLa acetilación del ácido acético disminuye la irritación intestinal y le quita el desagradable sabor amargoso.En un laboratorio, primero se administró la sustancia en animales y después en humanos.Sí, porque una vez recopilados todos los datos experimentales, estableció una relación entre las variables, las cuales se compararon e interpretaron, se analizaron los datos y pudo emitir resultados.Que efectivamente la acetilación del ácido salicílico disminuye los efectos secundarios.
Clasificación de la materia
Pág. 63
Completa la tabla.

Propiedades de la materia
Pág. 67
Clasifica.

Cambios de la materia
Pág. 72
Clasifica las propiedades físicas y químicas de la materia.

Cinco elementos de la vida cotidiana que sufran los tres cambios de la materia.
Agua: cuando pasa por su estado líquido, sólido, y gaseoso (físico) y dentro del organismo (químico)Leche: cuando hacemos quesos, pasa de líquido a sólido (físico) y cuando las proteínas se desnaturalizan por la ebullición (químico)Gelatina: cuando la preparas es lîquida y pasa a sólida (físico) necesita de la ebullición para poder diluirse (químico)Pastel: cuando se prepara pasa de líquido a sólido (físico) y cuando los horneas pasan por cambios (químico) algunos de sus componentes.Sudar: porque es sólido en tu cuerpo, líquido cuando logras ver tus gotas de sudor y gaseoso cuando se evapora (físico). Además desechas sustancias que tu cuerpo no necesita (químico).
Identifica el cambio de estado
Tabla:FísicoFísicoFísicoFísicoFísicoFísicoFísicoQuímicoQuímicoQuímico
Modelos atómicos y partículas subatómicas
Pág. 99
Relaciona las columnas.
abcaabcc
Conceptos básicos
Pág. 108
Completa la tabla.

Calcula la masa atómica
Respuestas:
Los isótopos y sus aplicaciones
Pág. 112
Completa la siguiente tabla con los datos que te solicitan.

Determina el número atómico, el número de neutrones, y el número de masa de cada elemento.

Configuración electrónica y números cuánticos
Pág. 118
Desarolla un mapa conceptual con la información que se te solicita sobre los números cuánticos.

Elabora las configuraciones electrónicas de los siguientes elementos.

Realiza la configuración electrónica de los elementos que se especifican.

Completa la siguiente tabla.

Elementos químicos
Pág. 149
Construye una línea del tiempo.

Propiedades periódicas y su variación en la tabla periódica
Pág. 162
Responde las siguientes preguntas
4) Con mayor: Flúor y con menor: Francio5) VII A6) El orden sería: F, Cl, Be, Na, Rb.7)
Regla del octeto
Pág. 190
Completa la siguiente tabla con la información que hace falta.

¿Qué representa la estructura de Lewis?
Representa los últimos electrones de la capa de valencia.
Relaciona las columnas.

Formación y propiedades de los compuestos con enlace iónico
Pág. 196
Completa la siguiente tabla.

Formación y propiedades de los compuestos con enlace covalente
Pág. 199
Explica la formación de los siguientes compuestos covalentes.

Ordena cada uno de los conjuntos de elementos en orden creciente de electronegatividad.

Indica si se trata de un compuesto iónico o covalente.

Reglas de la UIQPA para escribir fórmulas y nombres de los compuestos químicos inorgánicos
Pág. 233
Clasifica las siguientes columnas según corresponda al origen del nombre de cada elemento.
Curio – cTantalio- dPrometio- dZirconio bFrancio- aRubidio- bNobelio- cGemario- a
Asigna el número de oxidación a los siguientes elementos:
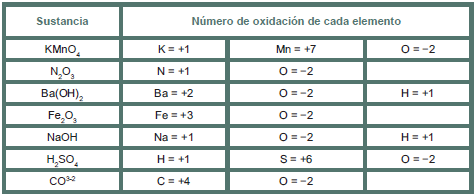
Óxidos no metálicos
Pág. 246
Determina el número de oxidación con la que actúan los metales en los siguientes óxidos y escribe su nombre de acuerdo con la nomenclatura señalada.

Escribe el número que identifica al compuesto por su nombre.
613542
Hidróxidos
Pág. 252
Escribe dentro del paréntesis de la derecha la letra V si la fórmula corresponde al nombre, y una F si no corresponde.
FVFFVVFVV
Oxiácidos
Pág. 254
Completa la siguiente tabla con la parte que falta a cada reacción.

Sales
Pág. 256
Completa la información que se solicita.

Escribe el grupo al que corresponde cada compuesto.

Escribe el nombre o la fórmula según corresponda.

Escribe el número de oxidación de los siguientes elementos.

Símbolos en las ecuaciones químicas
Pág. 281
Escribe la ecuación química de las siguientes reacciones.

Tipos de reacciones químicas
Pág. 284
Explica de forma verbal las reacciones que ocurren en cada una de las siguientes ecuaciones:
Explicación verbal:Una molécula de hidrógeno gaseoso más una molécula de cloro gaseoso nos da dos moléculas de ácido clorhídrico.Una molécula de cloro gaseoso más una molécula de hidrógeno gaseoso nos da dos moléculas de ácido clorhídrico.Una molécula de sulfato de cobre (II) sólido más una molécula de hierro sólido nos da una molécula de sulfato de hierro (II) sólido más una molécula de cobre sólido.Una molécula de carbono sólido más una molécula de agua nos da una molécula de anhídrido carbonoso más una molécula de hidrógeno gaseoso
Sustitución o desplazamiento doble
Pág. 288
Identifica a qué tipo de reacción pertenecen las siguientes fórmulas generales.

Escribe la ecuación química de descomposición.

Completa cada una de las ecuaciones de sustitución de las sustancias propuestas.

Clasifica según el tipo de reacción.

Balanceo de ecuaciones químicas. Tanteo
Pág. 294
Balanceen por tanteo las siguientes ecuaciones químicas.

Escribe la ecuación química para cada una de las siguientes reacciones y balancéelas por tanteo.

Óxido-reducción
Pág. 299
Balancen cada ecuación y señales a qué tipo de reacción pertenece.

Identifica cuál elemento se oxida y cuál se reduce.

Balancea las siguientes ecuaciones por el método de óxido-reducción.
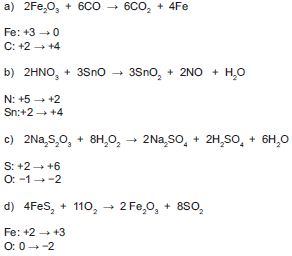
Responde las siguientes preguntas
Los secretos de los materiales.Es una doctora en física e investigadora en Materiales y Dispositivos en Película Delgada, escritora de artículos científicos, madre de familia, que experimenta en películas delgadas elaboradas con óxido de zinc mediante una técnica llamada rocío pirolítico.
Las ciencias de los materiales estudian y perfeccionan los materiales ya existentes, para lograr que sean más resistentes, durables y fáciles de elaborar a un bajo costo, cumpliendo las características particulares de acuerdo con su uso; así como la creación de nuevos materiales que satisfagan problemas y devergencias en otras ciencias con los avances científicos y tecnológicos.
Parte de una ciencia, especialmente de la física, la química y la biología, que estudia los fenómenos observados en estructura y sistemas extremadamente pequeños, mesurables en nanómetros.Materiales con átomos agrupados ordenadamente en agrupaciones de tamaño nanométrico, los cuales son la base para construir estructuras mayores de este tipo de materiales.
Cualquier material con una dimensión menor de 1-100 nm.Con películas delgadas elaboradas con óxido de zinc mediante una técnica llamada rocío pirolítico. Estas películas tienen la propiedad de degradar contaminantes orgánicos presentes en el agua. Las películas se introducen en el agua y al ser iluminadas producen reacciones fotocatalíticas que la limpian.
Producir materiales con alta actividad fotocatalítica; es decir, que absorbiendo luz realicen reacciones químicas de oxidación y reducción para descomponer moléculas complejas presentes en el agua residual. Los fotocatalizadores que desarrollan se activan con la luz del sol, lo cual los hace eficientes y costeables.
Entalpía de formación
Pág. 330
Determina las entalpías de reacción para las siguientes reacciones químicas.

Reacciones exotérmicas y endotérmicas
Pág. 334
Determina si la reacción es exotérmica o endotérmica.
Tipo de reacciónExotérmicaExotérmicaExotérmicaExotérmicaExotérmica
Determina si se trata de un proceso endotérmico o exotérmico.
Tipo de reacción.ExotérmicaExotérmicaExotérmicaEndotérmicaEndotérmica
Velocidad de reacción
Pág. 336
Elige la respuesta correcta en cada oración.
(d)(a)(b)(c)
muy buen trabajo
muy bien
chido