Libro de Química 3 grado de secundaria Volumen II
¿Buscas las respuestas a todas las preguntas del libro de Química 3 grado de secundaria? Aquí podrás consultar las respuestas de otros libros o descargar los documentos en PDF para tenerlos siempre a mano.
Puedes seguir haciendo scroll y encontrar las soluciones o pulsar ctrl + f (cmd + f en mac) en tu ordenador para buscar la respuesta a una pregunta que te han puesto como tarea. Te recomendamos que antes de mirar la respuesta intentes buscarla por ti mismo/a y que utilices esta página para comprobar si es correcta.
Libro de Química 3 grado de secundaria Volumen II CONTESTADO
Puedes consultar las respuestas online o descargar el PDF aquí.
⇨ Navega por el índice de contenidos para conocer la respuesta que estás buscando: Aquí;

Las sustancias y sus representaciones
Pág. 12
1. Investiguen en la biblioteca los símbolos químicos de los elementos hidrógeno, carbono, oxígeno y nitrógeno.
Hidrógeno: HCarbono: COxígeno: ONitrógeno: N
2. Observen las siguientes imágenes que representan sustancias.
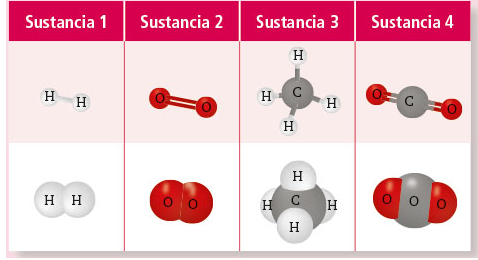
3. ¿Cuáles de ellas representan compuestos?
Sustancias 2 y 3
¿Y cuáles son sustancias elementales?
Sustancias 1 y 2
Expliquen sus respuestas
Las sustancias 1 y 2 se encuentran compuestas del mismo elemento, mientras que las sustancias 3 y 4 no.
En grupo, y con ayuda del maestro, discutan qué tipo de información proporciona cada representación, por ejemplo: cantidad de átomos, o interacción entre ellos. Comenten las ventajas y desventajas de cada una de ellas.
La primera representación de las moléculas es explícita en cuanto a qué tipo de enlaces (simples o dobles) se encuentran formados entre los átomos.
4. Propongan una forma diferente de representar esas sustancias; indiquen el tipo de átomos que las forman y el número de cada uno de ellos. Pueden utilizar sus símbolos químicos.
Pueden representarse mediante estructuras de Lewis.
1. En la hoja que utilizaron para la actividad 1, anoten la fórmula química de los compuestos representados en la tabla.
Sustancia 1: H2Sustancia 2: O2Sustancia 3: CH4Sustancia 4: CO2
3. Revisen en el tema 6 el concepto de electrones de valencia, y comenten cómo representarían las interacciones entre los átomos que forman a estos compuestos.
Las interacciones se representan mediante la compartición de electrones de valencia entre los átomos.
2. De su carpeta de trabajo, saquen la hoja que usaron en la actividad 1. Dibujen nuevamente los símbolos de los compuestos de la actividad 1, pero agreguen puntos que representen los electrones de valencia en cada elemento. Vean el ejemplo del nitrógeno que se presenta a la derecha.

3. Identifiquen cuántos electrones faltan para que los elementos tengan su última capa llena. Para cada compuesto, acomoden los elementos de manera que, compartiendo electrones, completen sus capas electrónicas. Usen como guía la representación de esferas y barras. Marquen los enlaces formados entre pares de átomos.
Electrones faltantesH: falta 1 electrónC: faltan 4 electronesO: faltan 2 electronesEstructuras
Trabajen en equipos. Para esta actividad necesitarán papel, plastilina, arcilla o migajón con pegamento, y palitos de madera.
1. A partir de la información de la tabla 2.1, y el modelo de Lewis, hagan una predicción de la geometría de las siguientes sustancias:
a) Metano (CH4)b) Metanol (CH3OH)c) Benceno (C6H6)Dibújenlas en una hoja.

2. En parejas, contesten en su cuaderno.a) ¿Qué tienen en común el grafito, el grafeno y el diamante?
Todas están compuestas solamente de carbono.
b) ¿Qué propiedad es diferente entre el grafito y el diamante?
La dureza, la cual está dada por una estructura diferente.
C) ¿Cuál es la diferencia estructural entre el grafito y el grafeno?
El grafeno es solo una de las láminas hexagonales de las cuales está compuesta el grafito.
d) ¿Qué tipo de enlaces hay en los alótropos del carbono? Expliquen su respuesta.
Covalentes. Todos los átomos son iguales, por lo que no habrá pérdida ni ganancia de electrones, solo compartición.
e) Investiguen las aplicaciones del grafeno al desarrollo de tecnología
El grafeno ha sido ampliamente investigado debido a la alta resistencia, flexibilidad y ligereza que presenta.
Pregunta inicial¿Por qué distintos compuestos forman cristales diferentes?HipótesisRedáctenla considerando el tipo y tamaño de los átomos que forman a los compuestos.
Cristales diferentes son formados debido a que los iones que componen los compuestos son de diferente tamaño y tienen propiedades distintas, por lo que la forma más estable para su acomodo variará.
Anoten en su cuaderno lo siguiente.a) Investiguen la fórmula química y la representación de Lewis de cada compuesto utilizado.

2. Determinen qué muestra corresponde a uno de los siguientes tipos de compuestos: covalente, metálico, e iónico. Anótenlo en su cuaderno.
Muestra 1: MetálicoMuestra 2: IónicoMuestra 3: CovalenteMuestra 4: Covalente
3. Contesten en su cuaderno lo que se pide:a) ¿Qué tipo de enlace tienen las sustancias con mejor conductividad?
Metálico
b) ¿Qué enlace químico presentan las sustancias con menor temperatura de fusión?
Covalente
a) ¿Cuál es la diferencia entre estos alótropos del oxígeno?
El número de oxígenos que tiene cada una de las moléculas
b) ¿Qué tipo de enlaces están presentes en ellos?
Enlaces covalentes.
c) ¿Son compuestos o sustancias elementales? Argumenta tu respuesta
Son sustancias elementales, ya que solamente están formadas por un tipo de elemento (el oxígeno).
2. Analiza las fórmulas químicas del agua y del peróxido de hidrógeno (agua oxigenada) y contesta lo que se pide.H2O H2O2a) ¿Estas sustancias son alótropos? Explica tu respuesta
No, ya que no están formadas de un tipo de elemento.
b) ¿Qué tipo de enlace está presente en cada caso?
En ambos casos están presentes enlaces covalentes polares.
C) ¿Son compuestos o sustancias elementales? Explica
Son compuestos, ya que están formadas por dos tipos de elementos distintos (H y O)
3. En pareja, realicen lo siguiente.a) Investiguen qué son los clorofluorocarbonos, su estructura molecular y cómo afectan a la capa de ozono.
Los clorofluorocarbonos (CFCs) son moléculas derivadas de hidrocarburos en las cuales hidrógenos han sido sustituidos por flúor o cloro.Están compuestos de carbono, hidrógeno, flúor y cloro.Degradan la capa de ozono, ya que los enlaces halógeno-carbono se pueden romper para producir radicales libres (especies químicas muy reactivas con un electrón desapareado), los cuales catalizan (hacen más rápida) la degradación de ozono a oxígeno.
La reacción química y la conservación de la materia
Pág. 24
3. Discutan qué tipo de información requerirían para determinar la cantidad de sustancias iniciales necesarias para producir un gramo de yoduro de plomo. Compartan sus respuestas con el resto del grupo. Con ayuda de su maestro analicen cuál sería la forma más adecuada de representar el proceso químico.
Se requiere conocer la relación con la cual el nitrato de plomo y yoduro de potasio reaccionan (es decir, la relación estequiométrica) la cual viene representada por una reacción química:
1. Lean las descripciones de las siguientes transformaciones:a) Dos moléculas de hidrógeno diatómico gaseoso (H2) y una de oxígeno diatómico gaseoso (O2) dan lugar a dos moléculas de agua en estado líquido (H2O).b) El carbono sólido (C) reacciona con el cloro diatómico gaseoso (Cl2), de tal manera que cada átomo de carbono se une a dos moléculas de cloro para formar una molécula de tetracloruro de carbono (CCI4) líquido.c) En presencia de luz, dos moléculas de peróxido de hidrógeno líquido (H2O2) se descomponen en dos moléculas de agua (H2O) en estado líquido y una de oxígeno diatómico gaseoso (O2).

1. Balanceen la ecuación química:

2. Escriban en una hoja aparte la fórmula química y la estructura de Lewis de cada una de las sustancias que se muestran a continuación considerando el siguiente código de colores:Blanco: hidrógeno (H)Negro: carbono (C)Rojo: oxígeno (O)Morado: yodo (I)

3. Ahora, escriban las ecuaciones químicas correspondientes y balancéenlas.

4. Para cada caso, indiquen cuántos enlaces se rompen y cuántos se forman en los reactivos y los productos.
a) Se rompen dos y se forman dosb) Se rompen 6 y se forman 6c) Se rompen 2 y se forman 4
5. Expliquen cuál de las tres representaciones (química, Lewis o calotte) les parece más conveniente para lo siguiente y expliquen por qué.a) Saber cuántos átomos de cada elemento hay en los productos y reactivos.
Química, ya que en las fórmulas se pueden identificar fácilmente con los subíndices.
b) Balancear la ecuación química.
Química, ya que es fácil reconocer cuantos átomos de cada elemento hay en los reactivos y productos.
c) Identificar cuántos enlaces se rompen y cuántos se forman.
Lewis, ya que en las estructuras se encuentran dibujados los enlaces y es más sencillo contabilizarlos
El amoniaco (NH3) fundamental en los fertilizantes, se obtiene a partir de la reacción química:1. Balanceen la ecuación y anoten el resultado en una hoja aparte.

2. Contesten lo siguiente con ayuda de su maestro:a) Si se considera la ecuación balanceada, ¿cuántos moles de hidrógeno se requieren para que reaccionen dos moles de nitrógeno?
6 moles de hidrógeno
¿Cuántos moles de amoniaco se producen?
4 moles de amoniaco.
b) Calculen la masa molar de cada sustancia. Consideren que MN = 14 g/mol y MH=1 g/mol.
N2: 28 g/molH2: 2 g/molNH3: 17 g/mol
c) A partir de la reacción balanceada, ¿en este proceso hay la misma masa en productos que en reactivos? Multipliquen la masa molar de cada compuesto por su coeficiente estequiométrico.

No, eran iguales.
Analicen las siguientes preguntas y anoten sus respuestas en una hoja aparte.a) ¿La masa de un reactivo era diferente a la del otro?
No, eran iguales.
b) ¿Cuál era la proporción entre el número de partículas de cada reactivo?
C/O2=8/3
c) En caso de que haya sucedido, argumenten por qué sobró alguno de los reactivos, ¿cuál es el reactivo limitante?
Porque solo había oxígeno suficiente para reaccionar con 12 partículas de carbono, por lo que sobran otros 20 átomos sin reaccionar. Por lo tanto, el reactivo limitante en este caso es el oxígeno (O2).
La rapidez de las reacciones químicas
Pág. 36
1. Responde lo que se te pide.a) Explica por qué la comida se conserva por más tiempo dentro de un refrigerador que al estar expuesta a condiciones ambientales
Porque las temperaturas bajas inhiben la proliferación de microorganismos, los cuales son los responsables de “echar a perder” la comida.
b) A partir de lo que sabes de concentración, ¿qué se descompone más rápido, un caldo concentrado, como el pozole, o uno diluido? Pregunta a alguien que sepa de cocina para corroborarlo
Uno concentrado, ya que contiene una mayor cantidad de nutrientes, los cuales son utilizados por los microorganismos
2. En equipo, enlisten en su cuaderno otros ejemplos de cambios químicos cotidianos e identifiquen si son más rápidos o más lentos.
Ejemplos: crecimiento de moho en el pan, oxidación de frutas y verduras, oxidación del acero, etc.
La siguiente gráfica muestra la producción de dióxido de carbono (CO2) de la reacción de efervescencia entre el bicarbonato de sodio (NaHCO3) y el ácido sulfúrico (H2SO4) para producir sulfato de sodio (Na2SO4), dióxido de carbono (CO2) y agua (H2O).
Los volúmenes de CO2 obtenidos en ciertos intervalos de tiempo se registran en la tabla siguiente.
1. Con ayuda del maestro, calculen lo siguiente: si en las condiciones de la reacción 1 mol de gas ocupa 22.4 L, es decir, 22 400 ml, ¿a qué cantidad de moles de CO2 corresponden estos volúmenes? Copien la tabla en una hoja aparte para anotar sus respuestas.

2. Para calcular la rapidez de producción de CO2, dividan la cantidad de sustancia entre el lapso requerido para producirlo, t (s). Usen los datos de la tabla para graficar la rapidez de reacción (mol/s) en relación con el tiempo (a).

3. Contesten: ¿la rapidez de reacción aumenta o disminuye al paso del tiempo? Elaboren una hipótesis para explicar a qué se debe esto considerando para ello lo que les sucede a los reactivos durante la reacción
La rapidez de reacción disminuye a lo largo que pasa el tiempo debido a que los reactivos han sido consumidos y hay una menor cantidad de estos disponibles para realizar la reacción química.
2. Con ayuda del maestro, llenen la tabla utilizando la siguiente información.Cantidad de sustancia: n = m/M Masas molares: MNaHCO3, = 84 g/mol;MCH3COOH = 60 g/molConcentración molar: C= n/V

Análisis y discusiónComparen sus resultados con los de otros equipos y, si es necesario, repitan procedimientos para determinar la combinación correcta de disoluciones.
La combinación de soluciones que produce la reacción más rápida es A1-B1. Esto se debe a que, al estar más concentradas, hay una mayor cantidad de partículas de los reactantes, lo cual aumenta la probabilidad de que las moléculas choquen entre sí para llevar a cabo la reacción química. Así, al haber una mayor frecuencia de choques moleculares, hay una producción de efervescencia mayor.
Conclusión¿Se confirmó su hipótesis? ¿Por qué? A partir de sus experiencias, expliquen cómo se relaciona la rapidez de las reacciones con la concentración de las disoluciones.
La rapidez de las reacciones químicas es proporcional a la concentración de los reactivos en las disoluciones.
1. Con base en la gráfica, contesta: ¿a qué temperatura corresponde cada línea en la gráfica? Copia la tabla en tu cuaderno y argumenta tu respuesta.
Al aumentar la temperatura se espera una producción de efervescencia más rápida ya que, molecularmente, esto representa un aumento en la velocidad de las partículas de los reactantes, lo cual hace más comunes los choques entre ellos, provocando una reacción más rápida.
2. ¿En qué momento consideras que finaliza cada reacción? Puedes apoyarte en la gráfica para contestarlo. ¿Qué evidencias físicas te permitirían determinar el fin de la reacción?
Finalización de las reaccionesA: ~30 sB: ~40 sC: ~ 40 sLa evidencia física es la desaparición casi completa de la efervescencia.
5. En equipo, disuelvan las tabletas en cada uno de los vasos y establezcan cuál es la relación entre la temperatura del agua y la rapidez de la reacción. Con ayuda de su maestro, comprueben sus respuestas a los puntos uno y dos.
La rapidez de reacción es proporcional a la temperatura del agua.
6. En grupo, redacten una conclusión de lo que aprendieron. Incluyan una explicación acerca de cómo aprendieron eso a partir de lo que observaron, lo que midieron y lo que analizaron en la gráfica.
La rapidez de reacción es proporcional a la temperatura, ya que aumentar la temperatura se traduce en el aumento de colisiones intermoleculares, que promueven la reacción química.
a) Calculen las frecuencias de las colisiones para cada caso. Dividan el número de colisiones entre el tiempo. Organicen sus datos en una tabla.b) ¿En cuál caso es mayor la frecuencia? ¿En cuál menor? ¿A qué se debe?
Es mayor con más canicas y con movimientos más bruscos. Es menor en el caso opuesto.
c) Redacten una conclusión para explicar cómo afecta la concentración de partículas a la frecuencia de las colisiones y ésta a la rapidez de las reacciones químicas. Incorporen el efecto de la temperatura, recuerden la relación entre temperatura y rapidez de las partículas.
Una concentración alta de reactivos durante una reacción química aumenta su rapidez debido a que las colisiones entre partículas se hacen más probables y frecuentes. Asimismo, un aumento en la temperatura se traduce en el aumento de la velocidad con la que se mueven las partículas, haciendo mayor también la frecuencia de los choques.
2. Expliquen las consecuencias de las siguientes acciones con base en la relación entre la rapidez de reacción y la concentración de los reactivos y la temperatura.a) A algunos pacientes con afecciones en las vías respiratorias se les hace inhalar oxígeno. Recuerda cuál es la función del oxígeno en nuestro metabolismo.
Aumentar la concentración de oxígeno en personas con deficiencia para aprovecharlo resulta beneficioso porque así se compensa la incapacidad de utilizarlo al aumentar la frecuencia de las colisiones de las partículas de este gas con la hemoglobina de la sangre.
b) Para que los embriones se desarrollen adecuadamente, las aves empollan sus huevos
Aumentar la temperatura hace que las reacciones bioquímicas que ocurren dentro de los embriones se lleven a cabo a la rapidez adecuada para su supervivencia
c) Algunos alimentos son empacados al vacío para que se conserven en buen estado por más tiempo
Disminuir la concentración de oxígeno hace que las reacciones de oxidación que degradan al alimento sean más lentas.
La energía y las reacciones químicas
Pág. 56
2. Contesten en una hoja aparte.a) ¿Qué cambio se lleva a cabo?
La liberación de energía
b) ¿Qué evidencia hay de que ocurrió un cambio?
Se ha producido una llama
3. En grupo y con la ayuda de su maestro, comenten lo siguiente:a) Al agregar sodio al agua, ¿cómo se puede saber si el sistema absorbe o libera energía?
Midiendo la temperatura del agua en el sistema, si aumenta, liberó energía y viceversa.
b) ¿De dónde proviene la energía que se ha transferido?
De la liberación de electrones al agua y la ruptura de los enlaces metálicos.
4. Mencionen otros ejemplos en los que identifiquen una reacción química a partir de la liberación de energía que ocurre en ella. Pueden ilustrar sus ejemplos con dibujos
Un ejemplo representativo es la combustión de cualquier sustancia.
5. Con base en lo que han aprendido hasta ahora, propongan una forma de medir la energía que absorbe o libera una reacción química.
En un baño de agua, se mide el efecto que tiene la reacción química sobre su temperatura, la cual está relacionada con la energía liberada o absorbida. A este aparato se le conoce como calorímetro.
Utiliza una hoja para contestar lo que se pide.1. Considera las afirmaciones que se dan a continuación acerca del intercambio de energía en algunas reacciones químicas, y con base en ellas, coloca E donde corresponda en las siguientes ecuaciones químicas. No olvides balancear las ecuaciones que así lo requieran· Las reacciones de combustión siempre son exotérmicas.· Al disolver una sal en agua, la temperatura del sistema disminuye.Reacciones:

1. Utilicen la información sobre la energía del enlace H—H y la que se presenta en la siguiente tabla. Calculen cuánta energía produce o requiere cada una de las reacciones que se indican y determinen si son exo o endotérmicas.
La reacción es endotérmica y se liberan 5 kJ de energía por mol de reacción.
Comenten en equipo; utilicen sus apuntes de temas anteriores para ello.a) ¿Cuál de los metales utilizados se oxida más rápido?
El aluminio
b) ¿Qué les ocurre a los electrones de un material que se oxida fácilmente?
Son transferidos a otro que tiene la capacidad de aceptarlos.
c) ¿De qué terminal salen los electrones y cuál los recibe?
Salen de la terminal negativa y van hacia la positiva.
d) ¿Qué función cumple la disolución de sal?
Tiene la función de completar el circuito entre los dos electrodos sin que ambos mantengan contacto directo entre ellos.
e) Argumenten si la reacción es endotérmica o exotérmica
Debe ser exotérmica, ya que se libera energía en forma de electricidad.
2. Planteen y hagan el balanceo de las reacciones de combustión de cada una de ellas.

3. Para cada una de las reacciones, cuenten los enlaces que se rompen y los enlaces que se forman.
Reacción 1: 6 enlaces rotos y 6 enlaces formadosReacción 2: 15 enlaces rotos y 14 enlaces formadosReacción 3: 21 enlaces rotos y 20 enlaces formadosReacción 4: 75 enlaces rotos y 68 formados
4. En grupo y con la ayuda de su maestro, discutan por qué la energía de combustión de estas sustancias crece conforme aumenta el número de carbonos en ella, como se muestra en la siguiente tabla.
Porque la reacción de combustión libera la energía contenida en un mayor número de enlaces C-H al convertirse estos en enlaces C=O.
1. Observen las siguientes estructuras desarrolladas de compuestos usados como combustibles. Escriban su fórmula química.
Metano: CH4Propano: C3H8Etano: C2H6Octano: C8H18
1. De manera individual, escribe en qué formas podemos transformar la energía química almacenada en la biomasa de origen vegetal (madera, almidón, aceites).
Mediante la combustión, oxidación en celdas electroquímicas, oxidación en celdas de combustible microbianas, etc.
2. ¿Qué beneficios tendría para el país si todas las industrias funcionaran como las plantas aprovechando la energía lumínica proveniente del Sol?
Disminuirían las emisiones de dióxido de carbono y otros gases de combustión dañinos, produciendo un ambiente más limpio y sano para la sociedad.
La tabla periódica de los elementos
Pág. 68
1. En parejas, observen los materiales que aparecen en las imágenes y en una hoja aparte anoten lo que se pide:a) ¿Cuáles materiales son mezclas, compuestos o sustancias elementales?

b) Propongan tres maneras de clasificarlos con base en sus propiedades.
Se pueden clasificar con base en si conducen o no la electricidad, los tipos de enlaces que constituyen al material, su punto de fusión, composición, etc.
2. En grupo, comenten sus propuestas de clasificación.3. Con ayuda de su maestro concluyan si con alguna de sus propuestas es posible distinguir a las sustancias elementales del resto. ¿Qué datos les permitirían proponer una mejor clasificación? Enlístenlos.
Para conocer si se trata de una sustancia elemental o no, sería pertinente contar con la composición de los materiales.
a) Observen los elementos del grupo 1 y describan cómo son las tendencias de los valores de temperaturas de fusión.
La temperatura de fusión baja conforme nos movemos de arriba hacia abajo en el grupo.
b) Hagan lo mismo para los elementos del grupo 17, ¿qué diferencias observan?
La temperatura de fusión tiende a aumentar conformo se baja en el grupo 17.
2. En una hoja de papel cuadriculado elaboren una gráfica de las temperaturas de fusión y ebullición (en el eje vertical) en función del número atómico (en el eje horizontal) de los elementos químicos de los periodos 2 y 3. Realicen lo que se indica a continuación:

a) ¿Observan alguna tendencia en su gráfica? Expliquen
Los valores tienden a disminuir al moverse de izquierda a derecha en un periodo, pero una vez que el periodo cambia vuelven a aumentar para seguir la misma tendencia
b) Describan en qué difieren o se parecen las dos propiedades
Ambas siguen las mismas tendencias, pero las temperaturas de ebullición son más altas.
3. Conviertan los datos de temperatura que están en kelvin a grados centígrados (°C) y después realicen lo que se pide:a) Con base en los valores de las temperaturas de ebullición, ¿qué sustancias podrían encontrar en estado gaseoso dada la temperatura de su salón de clases?
Al, N, O, F, Ne, Cl y Ar.
b) Investiguen en internet o en la biblioteca cuáles elementos de la tabla periódica se encuentran en forma gaseosa en la naturaleza.
H, He, N, O, F, Ne, Cl, Ar, Kr, Xe y Rn.
4. Contesten las siguientes preguntas en una hoja aparte: a) En cada columna, ¿aumenta o disminuye la cantidad total de electrones? ¿Y en cada renglón?
Los electrones aumentan de izquierda a derecha en cada renglón y de arriba hacia abajo en cada columna.
b) ¿Qué le sucede a la cantidad de electrones internos a lo largo de cada renglón?
Se mantienen constantes.
c) ¿Sucede lo mismo con la cantidad de electrones externos, o de valencia, a lo largo de cada renglón?
No, estos aumentan.
d) Numeren los renglones de arriba hacia abajo, ¿cuál es la relación entre estos números y los niveles de energía ocupados por los electrones para cada elemento?
Cada periodo tiene el número del último nivel de energía, donde se encuentran los electrones de valencia.
1. Con los datos de la tabla, elaboren dos gráficas en papel cuadriculado, coloquen en el eje horizontal el número atómico. En la primera gráfica pongan en el eje vertical el radio atómico y grafiquen los valores. Hagan lo mismo para la segunda gráfica, pero ahora en el eje vertical van los datos de energía de ionización. Anoten el símbolo del elemento que corresponda encima de cada punto de las gráficas.

2. Completen en una hoja aparte la numeración secuencial del 1 al 18 en la siguiente cuadrícula y coloquen los símbolos de los elementos en la casilla que contenga el valor de Z correspondiente.

3. Contesten las siguientes preguntas:a) A partir de las gráficas que elaboraron, ¿consideran que estas propiedades son periódicas? Argumenten su respuesta
Si, ya que siguen las mismas tendencias cada que cambia el periodo, que es cuando se observan los picos máximos.
b) ¿En qué lado de la cuadrícula se ubican los elementos que están en los picos más bajos de la gráfica de radio atómico y en los más altos de la energía de ionización
En la última columna (gases nobles)
c) ¿Cómo cambian el radio atómico y la energía de ionización a lo largo de cada renglón de la cuadrícula? ¿Y por columnas?
El radio atómico disminuye de izquierda a derecha en un renglón y aumenta de arriba hacia abajo en una columna. La energía de ionización aumenta de izquierda a derecha en un renglón y disminuye de arriba abajo en una columna.
d) ¿Qué valores de radio atómico y de energía de ionización estiman para el boro (B)?
r~100 pm y E1~8 eV
Según la escala de acidez de la figura, ¿qué tipo de sustancias se forman en cada vaso? ¿Qué elementos se combinan con el oxígeno en los pasos 5 y 6? ¿Y cuál es su posición en la tabla periódica? Relacionen esto con el carácter ácido o básico de sus óxidos.
El vaso con CaO contiene una sustancia básica, mientras que el vaso con CO2 contiene una sustancia ácida.En los pasos 5 y 6 se combinan moléculas de agua a los compuestos, uniéndose con el oxígeno el C y el Ca.Su posición confirma que el calcio tiene más carácter metálico, por lo que sus óxidos son básicos, mientras que lo contrario sucede para el carbono, cuyos óxidos tienden a ser ácidos.
Expliquen si se confirmó la hipótesis que plantearon. Ubiquen al azufre y al sodio en la tabla periódica, ¿son metales o no metales? Los óxidos que forman ¿son básicos o ácidos?
El Na es metal y el S es no metal. El óxido de sodio es básico y el de azufre es ácido.
Escriban en ellas las tendencias de las propiedades indicadas de acuerdo con lo que observaron en la actividad 5. Pueden apoyarse en las figuras 2.47 y 2.48.

2. Escriban en una hoja lo que se pide.a) En la tabla periódica, localicen los elementos químicos que se muestran.

b) Para cada elemento, anoten el número atómico, la masa atómica, el periodo y el grupo en el que se localiza.
AuNúmero atómico: 79Masa atómica: 196.97Periodo: 6Grupo: 11NaNúmero atómico: 11Masa atómica: 22.99Periodo: 3Grupo: 1HgNúmero atómico: 80Masa atómica: 200.59Periodo: 6Grupo: 12SNúmero atómico: 16Masa atómica: 32.1Periodo: 3Grupo: 16CNúmero atómico: 6Masa atómica: 12.01Periodo: 2Grupo: 14NeNúmero atómico: 10Masa atómica: 20.18Periodo: 2Grupo:18AlNúmero atómico: 13Masa atómica: 26.98Periodo: 3Grupo: 13
3. Investiguen en la biblioteca o en internet lo siguiente:a) ¿Qué elementos son líquidos a temperatura ambiente?
El mercurio y el bromo
b) Las tendencias del radio atómico y la energía de ionización en la tabla periódica. Compárenlas con sus respuestas al punto 1.
Son las mismas
1. En la naturaleza se encuentran los siguientes isótopos del neón con su respectiva abundancia: 20Ne 90.48%, 21Ne 0.27% y 22Ne 9.25%. Calculen su masa atómica y compárenla con su valor en la tabla periódica.
En la tabla periódica aparece 20.18 lo cual es 1.04% diferente.
2. Con la información de la actividad 2, estimen los valores del radio atómico y la energía de ionización para el fósforo (P). Investiguen después sus valores y compárenlos con sus estimaciones. A partir de esto, argumenten la importancia de la tabla periódica como herramienta predictiva.
r~ 95 pm E1~9 eV.Los valores reales son: r=110.15 pm y E1=10.5 eV. Las predicciones son muy similares a las mediciones experimentales, por lo que la tabla periódica es una herramienta muy poderosa para estimar las propiedades de los elementos.
3. Elijan un elemento de los primeros periodos del grupo 2 y otro similar del grupo 13.
Elementos elegidos: Na y Al.
Teniendo en cuenta sus electrones de valencia, ¿cuál tiene una energía de ionización más alta? Fundamenten su respuesta
El Al, ya que es más difícil arrancarle un electrón porque el núcleo contiene más protones y atrae con mas fuerza a los electrones de valencia.
4. Expliquen cuál de los elementos con números atómicos de 12 y 14 tiene un radio atómico mayor. Con base en su carácter metálico, determinen qué tipos de elementos son.
El elemento 12 tiene un radio atómico mayor debido a que la fuerza con la que el núcleo atrae a los electrones es menor, ya que tiene menos protones en él, lo que significa que el alcance espacial de los electrones será mayor.El elemento 12 (Mg) es un metal y el 14 (Si) es un metaloide.
5. En un experimento, el producto de la oxidación de estroncio se mezcla con agua. Considerando las propiedades de los elementos involucrados, respondan: ¿de qué color sería la mezcla si se agregaran unas gotas de indicador de col morada?, ¿de qué carácter sería la mezcla de acuerdo con la escala de color?
Se esperaría un color verde, lo que indica carácter básico.
Evaluación
Pág. 86
2. A partir de la reacción que el maestro Carlos escribió, realiza lo que se te solicita en cada inciso, para ello, utiliza lo que aprendiste en este bloque:a) ¿Cuántos elementos están presentes en esta reacción?
3 (H, Ca y O)
b) ¿Cuántas sustancias están presentes en esta reacción?
3 (CaO, H2O y Ca(OH)2
c) Clasifica cada una de las sustancias como iónicas o covalentes.
CaO: iónicaH2O: covalenteCa(OH)2: iónica
e) ¿En cuál de las sustancias de la reacción están presentes todos los elementos que intervienen en la reacción?
En el producto Ca(OH)2
f) Determina si la reacción química está balanceada. Si no, balancéala
Sí está balanceada.
g) Los cambios físicos en los granos de maíz durante la nixtamalización ocurren con mayor rapidez si se calientan y se aumenta la concentración de cal, ¿a qué se debe esta diferencia?
A que el aumento de la temperatura hace que las partículas se muevan con mayor rapidez, favoreciendo las colisiones necesarias para llevar a cabo la reacción química. Asimismo, aumentar la concentración incrementa también la frecuencia de las colisiones.
Observa la siguiente tabla, ordena los experimentos de menor a mayor a partir de las combinaciones de la concentración de cal y de la temperatura. Argumenta tu respuesta con base en el modelo de partículas.
C>A>BC es el experimento más rápido ya que contiene la mayoro concentración y temperatura. De ahí sigue B, el cual tiene la temperatura más alta de los experimentos restantes y por último se encuentra B, ya que es el experimento con menor temperatura y concentración. Temperaturas y concentraciones altas aumentan la frecuencia de las colisiones entre partículas y la rapidez de la reacción química.
h) En la nixtamalización los iones hidróxido provocan el cambio físico en los granos de maíz. Considerando los óxidos Na2O, CO2 y SO3 y recordando la reacción de formación de cal apagada, ¿cuál de ellos produciría compuestos útiles para el proceso de nixtamalización?
El Na2O
¿cuáles corresponden a óxidos de metales y cuáles a no metales? Puedes utilizar la tabla periódica para responder
El Na2O es un óxido de un metal, mientras que CO2 y SO3 son óxidos de no metales.
i) Al preparar cal apagada aumenta la temperatura del sistema ¿de qué tipo de reacción se trata?
Exotérmica
j) Si en vez de cal (CaO) se usa óxido de potasio, se lleva a cabo la siguiente reacción:Balancea esta reacción

· ¿Cuántos gramos de agua se necesitan para transformar 30 g de óxido de potasio (K2O) en hidróxido de potasio (KOH)? Utiliza las fórmulas químicas de los compuestos y los datos de las masas atómicas de los elementos para obtener las masas molares que ocuparás en los cálculos.

Reacciones químicas en el entorno
Pág. 90
Reacciones químicas en tu entorno 1. En equipos, observen las imágenes y contesten en su cuaderno: a) -¿Qué procesos químicos ocurren en la naturaleza?
Combustión, respiración, fabricación de un fertilizante, fermentación
¿Y cuáles podrían ser de utilidad en la industria química?
fabricación de un fertilizante
b) Propongan otras formas de clasificar los procesos químicos, considerando, por ejemplo: Estado de agregación de los productos;Número de reactivos que participan en la reacción;Aplicación en la vida cotidiana.
Se deja a consideración del alumno
Identificación de ácido y bases

Comenten con sus compañeros sus resultados:¿qué cambios ocurrieron en el clavo, en la disolución de sal y en las bolitas de aluminio? Complementen sus anotaciones
El clavo quedo tuvo una deposición de aluminio y el aluminio quedo con color café la sal quedó de color café
Trabaja de forma individual en tu cuaderno. 1.. Clasifica las siguientes reacciones como de síntesis, de descomposición o de sustitución simple o doble.

Las moléculas que estructuran a los seres vivos
Pág. 100
3. Enciendan la vela y realicen lo siguiente: a) ¿La lama de la vela puede replicarse y aumentar su tamaño? Anoten de qué formas lograrían esto.
Con un poco de oxígeno para que aumente la combustión
b) Soplen ligeramente sin apagar la llama, ¿ésta responde a estímulos del medio ambiente?
Si
c) Cubran la vela con el frasco, ¿qué se necesita para que se mantenga encendida?
Es necesario la presencia de oxígeno
d) Enciendan y cubran el trozo restante de vela, ¿cuánto tiempo durará encendida la llama?¿por qué?
2 o 3 min, debido a la falta de oxígeno
e) – ¿Bajo qué condiciones la llama de una vela se extingue?
En ausencia de oxígeno
1. Ubica a los bioelementos en la tabla periódica y contesta: a) – ¿Son metálicos o no metálicos?
No metálico
b) – ¿Qué tipo de enlaces pueden formar entre ellos? Explica tu respuesta.
De tipo covalente debido a que tiene electronegatividades similares
1. Observen la imagen que muestra la estructura de dos polímeros: la celulosa y elalmidón. Anoten en su cuaderno: a) ¿Qué tipo de carbohidratos son?
Son carbohidratos complejos
b) ¿En qué difiere su estructura? Argumenten su respuesta
la celulosa está formada únicamente por moléculas de glucosa, mientras que el almidón está formado por amilosa y amilopectina.
2. En la biblioteca o internet investiguen: _a) ¿En qué alimentos está presente el almidón?
En la papa, camote principalmente
¿Cuál estructura celular está constituida por celulosa?
Formado por dos moléculas de glucosa en específico. Beta glucosa
c) ¿Qué tipo de carbohidrato es el glucógeno y en qué células se encuentra? Dibujen su estructura.
El glucógeno es un polisacárido de reserva energética formado por cadenas ramificadas de glucosa.
1. Observen con atención las ecuaciones químicas que se muestran en esta página y contesten en una hoja aparte: a) Anoten los elementos presentes en cada una de las reacciones.
C, H, O
b) ¿Cuáles moléculas están presentes en las tres reacciones? Anótenlas.
CO2, H2O y O2
c) ¿Cuál molécula es el combustible en cada reacción?
CH4C6H12O6CO2 y H2O
d) ¿La fotosíntesis es una reacción endotérmica o exotérmica? Argumenten su respuesta
La fotosíntesis es una reacción endotérmica, puesto que la energía en forma de luz solar es absorbida por las plantas.
a) Con base en la figura de arriba, dibujen cómo quedarían unidos los tres aminoácidos por enlaces covalentes. ¿Cuántas moléculas de agua se libera al unir estos tres aminoácidos?
Se liberan tres moléculas
b) Además del C, H, O y N, ¿qué otro elemento puede estar presente en la estructura de los aminoácidos?
Azufre S
En la biblioteca o en internet investiguen cuáles ejemplos de proteínas mencionadas en el texto son estructurales y cuáles son enzimas. Expliquen por qué y anótenlo.
Las proteinas determinan la forma y la estructura de las células y dirigen casi todos los procesos vitales.Las proteinas estructurales se agregan a otras moléculas de la misma proteina para originar una estructura mayor.
Los enzimas son proteínas que catalizan reacciones químicas en los seres vivos. Los enzimas son catalizadores, es decir, sustancias que, sin consumirse en una reacción, aumentan notablemente su velocidad.
1. Observen con atención la estructura del monosacárido ribosa y del ácido graso valérico y realicen lo siguiente: a) Escriban la fórmula química para cada molécula.
Ácido valérico C4H10O2Ribosa C4H10O5
b) ¿Cuáles son las similitudes entre ambas moléculas?
La cantidad de carbono e hidrogeno
c) ¿Cuál de las dos moléculas tiene más átomos de hidrógeno?
Tienen la misma cantidad
d) ¿Cuál de las dos moléculas tiene menos átomos de oxígeno?
Ácido valérico
e) La ribosa y el ácido valérico son moléculas orgánicas. Expliquen por qué.
Debido a que tiene grupos tales como ácido carboxílico en el caso del Ácido valérico y aldehídos para el caso de la Ribosa.
2. Realicen lo que se pide en su cuaderno: a) ¿Qué elementos químicos conforman a los nucleótidos y qué tipo de enlaces los mantienen unidos? Argumenten su respuesta.
Carbono, fosforo, hidrogeno, oxigeno, nitrógeno El tipo de enlace que forman es de tipo covalente ya que los elementos son no metales y además tienen electronegatividades muy parecidas
b) Elijan un nucleótido y escriban su fórmula química. Utilicen el modelo de barras y esferas para representarlo.

La energía de los alimentos
Pág. 114
¿Dónde están los nutrientes? 1. Formen parejas y observen las imágenes. a) Para cada alimento, indiquen si aporta carbohidratos, lípidos o proteínas.
El pescado es el que aporta la mayor cantidad de proteína y en el caso del garbanzo aporte de carbohidratos; sin embargo todos los alimentos en la imagen tales como: zanahoria, ejotes aportan grasas, proteína y carbohidratos; algunos aportan mas que otros.
b) ¿Cuáles alimentos consideran más nutritivos? Argumenten su respuesta
Pescado y garbanzo, en el caso de pescado por el aporte de grasas, y proteína de alta calidad y en el caso del garbanzo por su aporte rico en carbohidratos
c) ¿De cuáles alimentos pueden obtener más energía? Expliquen por qué.
Del pescado y garbanzo; en el caso del pescado por su porte rico en proteína y los garbanzos por la parte de carbohidratos
d) Agrupen los alimentos de su región que contengan carbohidratos, lípidos y proteínas.

e) ¿Qué nutrientes aportan una bolsa de papas fritas y un refresco? Explica por qué este tipo de alimentos y bebidas no forman parte de una dieta correcta.
El aporte de las papas fritas en proteína es bajo y su aporte en lípidos es muy alto, en el caso del refresco es aporte en base de azúcar y nada rico en nutrimentos.
f) ¿En qué unidades se expresa la cantidad de energía?
Calorías y kilocalorías
a) Identifiquen el consumo energético, en kcal y kJ, que les corresponde diariamente de acuerdo con su edad, género y tipo de actividad física.
A consideración del alumno
b) ¿Por qué algunas personas tienen mayores requerimientos energéticos que otras? Argumenten su respuesta.
Las necesidades de energía en las personas mayores son menores que en los más jóvenes; como media disminuyen un 10% cada década a partir de los 60 años, por disminución de la masa celular activa y de la actividad física. En la tercera edad se deben consumir menos calorías, ya que si se mantiene la misma ingesta que en la edad adulta se corre el riesgo de presentar obesidad o agravarla. Aproximadamente se habla de un consumo de unas 2200 kilocalorías en varones de 65 años sedentarios y de 1850 en mujeres de la misma edad y características.
2. Determinen cuánta energía aportan los alimentos que consumen individualmente al día. Consideren lo siguiente: a) Supongan que en alguna de sus comidas incluyen una porción de enfrioladas. ¿A qué porcentaje de su requerimiento energético diario corresponde una porción?
Considerando una porción de enfrijolada como 2 enfrijoladas, el aporte por enfrijolada es de 162 cal por una porción son 324 cal
b) Anoten los alimentos que consumen en todas las comidas de un día incluyendo el contenido de azúcar de las bebidas.
A consideración del alumno
Contesta en tu cuaderno lo que se pide: a) Del total del consumo energético diario que requieres, calcula el porcentaje que representa tomar uno y dos refrescos por día.

b) Si cada refresco lo acompañas con una bolsa de papas fritas o cualquier otra golosina, ¿cuál sería tu consumo energético adicional al día?
228 kcal (papas) + 150 kcal (refresco) + 200 kcal (golosina) 578 kcal
La química y el medio ambiente
Pág. 124
Las imágenes en esta actividad corresponden a una misma ciudad, pero fueron captadas en diferentes días. 1. Obsérvalas y anota en tu cuaderno las diferencias que percibas entre ambas imágenes.
En la imagen de la izquierda se observa smogLos edificios no se pueden apreciar adecuadamenteNo se observan los paisajes como las montañas En la imagen de la derecha es cielo se observa claramenteSe aprecian los edificiosSe observan las montañas
2. En parejas, discutan a qué se deben las diferencias: ¿hay actividades humanas que provoquen estas diferencias?,¿cuáles?
Si hay actividades humanas tales como: smog de los autos, las empresas, consumo en exceso de combustibles, uso de ácidos para extracción de minerales.
3. En grupo y con la ayuda de su maestro, discutan: cuando el aire está en las condiciones de la imagen izquierda, ¿cómo se afecta la salud?, ¿y el medio ambiente?
A la salud la afecta ya que la personas pueden llegar a tener problemas respiratorios al medio ambiente por que lo se pueden llevar a cabo procesos naturales, se tiene contaminación del aire
1. De manera individual, investiga los siguiente en libros, revistas o internet. a) ¿Qué es el DDT?
El dicloro difenil tricloroetano o más exactamente 1,1,1-tricloro-2,2-bis-etano, de fórmula (ClC₆H₄)₂CH es un compuesto organoclorado principal de los insecticidas.
b) ¿A qué tipo de fauna combate? ¿De qué manera?
Insectos Combatiendo insectos a través de su efecto como insecticida
c) ¿Causa daño a las personas? ¿Por qué?
Si, Puede causar efectos en el sistema nervioso central dando lugar a convulsiones y un fallo respiratorio. Una exposición excesiva al DDT puede afectar a la glándula suprarrenal, al cerebro, hígado, nervio periférico, sistema reproductivo y al feto, pudiendo provocar cáncer y tumores.
2. Por parejas, discutan la pertinencia de utilizar insecticidas. Consideren las ventajas y los riesgos para su argumentación.
Es un riesgo usar insecticidas en exceso debido a los problemas con la fauna , su uso debe se limitado y solo en ocasiones necesarias ya que provoca daños a la flora y fauna.
3. En grupo, comenten sus resultados y, con la ayuda del maestro, elaboren dos listas, una que incluya las ventajas de los insecticidas y en la otra las afectaciones debidas a su uso.Colóquenlas en un lugar visible de su salón.

1. De manera individual investiga los siguiente a) ¿Qué es la tuberculosis y qué la causa?
La tuberculosis es causada por bacterias que se contagian de persona a persona a través de gotitas microscópicas diseminadas en el aire. Esto puede suceder cuando una persona con la forma activa de la tuberculosis no tratada tose, habla, estornuda, escupe, se ríe, o canta.
b) ¿A qué órganos afecta principalmente?
Por lo genera a los pulmones, pero también pueden atacar otras partes del cuerpo, como los riñones, la columna vertebral y el cerebro.
e) ¿Qué tratamiento se emplea para las personas afectadas?
Los medicamentos que se usan con más frecuencia para tratar la tuberculosis son:Isoniacida.Rifampicina (Rifadin, Rimactane)Etambutol (Myambutol)Pirazinamida.
d) ¿Por qué se dice que existe una forma resistente de la enfermedad?, ¿cómo surgió ésta?
La TB-MDR es definida como la TB con resistencia al menos a la isioniazida y la rifampicina, los dos más importantes medicamentos antituberculosos.
e) Menciona otras bacterias que desarrollen resistencia a los antibióticos.
· Enterococcus faecium, resistente a la vancomicina.· Staphylococcus aureus, resistente a la meticilina, con sensibilidad intermedia y resistencia a la vancomicina.· Helicobacter pylori, resistente a la claritromicina.
Las sustancias contaminantes
Pág. 136
1. Describan los posibles efectos negativos de la contaminación en su localidad. Guíense con la siguiente tabla para organizar su información en una hoja aparte.

1. Investiga cómo funciona el sistema de recolección de basura en tu comunidad.
Dos veces a la semana los camiones recolectores pasan por cada domicilio a realizar la recolección de la basura que los ciudadanos generamos y separamos debidamente. Una vez recolectada se traslada hacia el relleno sanitario donde se deposita.
2. En parejas, evalúen la situación de su comunidad con respecto a la basura. Registren sus hallazgos marcando (x) en la casilla que corresponda en una tabla como la siguiente:

3. ¿Qué tipo de basura ocasiona mayor contaminación en su localidad?
Ya se prohibieron en la localidad, pero las bolsas de plástico siempre han sido y siguen siendo el mayor contaminante. Hoy en día solo pueden utilizarse aquellas que sean biodegradables.
1. Elijan un producto de la imagen y contesten:
La industria del embutido salchichaJabón la industria de limpiezaPintura industria como comexShampoo industria como pantene
b) ¿Qué actividades del sector primario intervienen en la obtención de las materias primas para fabricarlo y cuáles del sector terciario para que el producto llegue hasta ustedes?
En el sector primario destaca la ganadería para la producción de la carne utilizada y la minería para la obtención de sal necesaria para el proceso. En el sector terciario encontramos el transporte del producto hasta las tiendas y la venta en el supermercado
c) Consideren lo anterior y, con ayuda de su maestro, mencionen los contaminantes que se generan por la elaboración, comercialización y consumo de ese producto. ¿Son biodegradables o de qué manera se manejan?
Para poder elaborar este producto se requiere criar ganado porcino o aves para obtener la carne como materia prima, esta actividad genera contaminantes como los propios desechos de los animales, los cuales son biodegradables. La obtención de la sal necesaria produce contaminantes no biodegradables como los gases de efecto invernadero.
1. Busquen información en libros o en internet sobre la calidad del aire en ciudades grandes.
La OMS menciona que existe una mala calidad del aire en casi todas las ciudades del mundo. Los niveles más altos de contaminación se encuentran en los países de bajos y medianos ingresos en las regiones del Mediterráneo Oriental y del sureste de Asia.
2. Investiguen cómo se identifican y monitorean los contaminantes.
En cada ciudad grande existen estaciones o laboratorios encargados de monitorear la calidad del aire mediante sensores. Los gases combustibles (dióxido de carbono y metano) se suelen monitorizar vía sensores catalíticos e infrarrojos, mientras que para la detección de gases tóxicos es habitual el uso de sensores electroquímicos y de semiconductores de óxido metal.Su forma de operación varía según el tipo de sensor, pero se pueden distinguir dos grandes grupos: los dispositivos que funcionan por absorción, contacto con el gas y reacciones químicas, y los sensores cuyo funcionamiento se basa en emisiones infrarrojas o ultrasónicas.
¿En qué casos debe utilizarse la destilación para separar contaminantes del agua?
Se puede utilizar siempre y cuando los contaminantes tengan un punto de ebullición distinto que el del agua que es de 100°C, preferiblemente debe ser menor.
2. Proporcionen un ejemplo de actividad humana que genere contaminación del aire, otro del agua y otro más del suelo. Incluyan información de los contaminantes generados, sus efectos en la salud y cómo se pueden detectar y separar del medio contaminado. Para esto, consideren lo que saben hasta ahora acerca de las mezclas y su separación, la detección de sustancias con base en sus propiedades y la eliminación de contaminantes.
Contaminación de aire: conducir un automóvil. Al conducirlo, la combustión de la gasolina en el motor genera gases nocivos para la salud, entre los que destacan el CO, CO2, NO2, SO3. Estos contaminantes son detectados por las estaciones encargadas de evaluar la calidad del aire.Contaminación de suelo: arrojar basura en las calles, la cual tapa alcantarillas o termina en arroyos, provocando en tiempo de lluvias inundaciones. Basta con observar para percatarnos de su presencia y puede ser eliminada depositándola en su lugar.
Beneficios de la química responsable
Pág. 148
1. En parejas, escriban qué es una reacción química, incluyan la función de los reactivos y los productos de la misma. Comparen sus respuestas con las de otras parejas y corrijan lo necesario.
Las reacciones químicas son procesos en los que una o varias sustancias cambian para formar una o más sustancias nuevas. La función de los reactivos es interactuar con otro reactivo para dar lugar a la formación de otras sustancias con propiedades, características y conformación distinta, llamados productos.
2. Argumenten lo siguiente: a) La utilidad de obtención de nuevos productos y su impacto en el medio ambiente.
Obtener nuevos productos ayuda a ampliar el abanico de opciones que tenemos las personas para facilitar nuestro día a día, pero en ocasiones hacer un mal manejo de estos productos pue afectar seriamente al medio ambiente contaminándolo.
b) Los posibles problemas de producir sustancias indeseadas.
En ocasiones, durante una reacción química se producen productos altamente contaminantes o inclusive tóxicos, los cuales si reciben un mal manejo pueden resultar nocivos para la salud de las personas.
c) La aplicación del conocimiento químico en la eliminación de sustancias nocivas.
Conocer como fueron producidos asi como conocer las características fisicoquímicas de los productos nos permiten crear estrategias aptas para su eliminación.
1. De manera individual, indaga con tus familiares qué productos químicos no existían cuando ellos tenían tu edad. Anótalos en una hoja aparte.
A consideración del alumno
Pregunta inicial: ¿Cómo se puede eliminar un gas de efecto invernadero como el CO2, por medio de reacciones químicas?
Los arboles lo hacen naturalmente mediante la fotosíntesis, un proceso que consiste en una serie de reacciones químicas que finalizan con la producción de azucares y oxígeno.
Análisis y discusión: En grupo y con la guía de su maestro, usen la información de la tabla para explicar, con sus palabras, lo que sucedió en este experimento. Pueden anotarlo en el pizarrón. Comenten de qué manera se introdujo el dióxido de carbono (CO2) y cómo se puede saber si se logró separar este compuesto.
A través del CO2 en el aire se disolvió en agua formando ácido carbónico H2CO3Para saber si el CO2 se logro separar se puede saber con un indicador de col morada ya que el CO2 en forma de ácido carbónico lo poner de color rosa.
2. Formen parejas y comenten lo que entendieron, ¿cómo piensan que ocurre el proceso de biotransformación de los metales tóxicos? Pueden ilustrar su escrito con dibujos y ecuaciones químicas.
Con el uso de bacterias se transforman las especies tóxicas de metales en unas menos tóxicas, a través de procesos redox
3. Investiguen qué metales tóxicos existen, el tipo de actividades que los generan, sus efectos en la salud y en medio ambiente. Indaguen si es posible biotransformarlos y de qué manera.
En México la industria minera libera al medio ambiente muchos metales tóxicos, entre los que destacan Mercurio, Plomo, Cadmio. Todos ellos altamente tóxicos para los humanos.
Evaluación
Pág. 162
¿Cuáles etapas generan disoluciones con pH básicos y cuáles con pH ácidos?
pH ácido en la etapa 3, etapa 4pH básico en la etapa 1, etapa 2
¿En qué partes del proceso se usa H2SO4?
En la etapa 3 y 4, debido a los pH ácidos
¿De qué tipo de reacción se trata? Argumenta tu respuesta.
Se trata de una de doble sustitución debido a que cumple con AB + CD = CD + AD Del tipo de neutralización se produce una sal más agua
Identifica y enlista los reactivos y productos en la reacción.

¿Dejar de usar piel y sustituirla por materiales como el nailon y el poliéster, resolvería los problemas de contaminación ambiental en la zona? Argumenta tu respuesta.
No del todo ya que el naylon y poliester se usa petróleo y es necesario dar un tratamiento con ácido.
Argumenta la relevancia de que la gente tenga acceso a información acerca de las reacciones químicas que se llevan a cabo como parte de las actividades industriales de sucomunidad, y los efectos de los residuos
Es necesario que conozcan las reacciones químicas y sus efectos al medio ambiente ya que conoce el peligro podrá prevenir su daño al medio; además de saber como tratar residuos
Gracias por compartir
Gracias por compartir para hacer más fácil nuestra labor en el aula.